大脑抗衰有“盾牌”!JCI Insight:钙泄漏触发GLO1解毒机制,老年后失效致阿尔茨海默病风险飙升
- 大脑
- 靶点
- tau蛋白
- 阿尔茨海默病
来源:生物谷原创 2025-12-05 11:04
科学家们不仅揭示了大脑应对早期神经退行性损伤的一种全新内在韧性机制,也为预防阿尔茨海默病提供了全新的干预靶点。
面对阿尔茨海默病的侵袭,我们的大脑并非毫无还手之力。最新研究发现,年轻健康的大脑自带一套精密的自我保护系统——当神经细胞内钙离子发生异常泄漏时,大脑会迅速启动乙二醛酶 1(GLO1)这一 “解毒蛋白”,抵消钙泄漏带来的毒性压力;然而这套天生的防御机制会随衰老逐渐失效,最终让大脑暴露在神经退行性损伤的风险中。
耶鲁大学医学院团队发表在《JCI Insight》上的研究 “Ryanodine receptor 2–mediated calcium leak is associated with increased glyoxalase I in the aging brain”,不仅揭示了大脑应对早期神经退行性损伤的全新内在韧性机制,更为阿尔茨海默病的早期预防提供了极具潜力的干预靶点。

提到阿尔茨海默病,人们往往先想到 β- 淀粉样蛋白斑块和 Tau 蛋白缠结,但科学家早已意识到,疾病发生前还存在更早期的功能性失调,其中细胞内钙离子稳态的破坏就是关键的上游诱因。每个神经细胞内的内质网都是储存钙离子的 “仓库”,而兰尼碱受体 2(RyR2)则是控制钙离子释放的 “水龙头”。
在衰老和疾病早期,RyR2 会因过度磷酸化(pS2808-RyR2)而 “关不紧”,导致钙离子持续泄漏到细胞内。过高的钙浓度对神经元具有强毒性,会引发线粒体功能异常、神经炎症等连锁反应,最终造成细胞功能障碍甚至死亡。全球超 5500 万痴呆症患者中,60%-70% 为阿尔茨海默病患者,寻找症状出现前的预防性策略是当下研究的核心方向,而这项研究正揭开了大脑对抗钙泄漏的 “自救” 密码。
研究的核心发现是,慢性 RyR2 钙泄漏会触发大脑中 GLO1 的表达和活性显著提升,这种关键解毒酶能在疾病早期为大脑筑起保护屏障。研究团队通过跨物种实验验证了这一关联:首先在老年恒河猴的前额叶皮层中,观察到 GLO1 表达随年龄增长明显升高,且其水平与 pS2808-RyR2 的含量呈正相关,进一步定位发现 GLO1 主要分布在神经元树突和星形胶质细胞中。
为了确认因果关系,团队又采用了 S2808D-RyR2 基因突变小鼠模型——这类小鼠的 RyR2 “水龙头” 持续处于打开状态,可精准模拟慢性钙泄漏。实验结果十分明确:突变小鼠早在 1 月龄时,其认知关键区域(前额叶皮层和海马体)的 GLO1 表达和活性就已显著升高,且随年龄呈现 “钟形曲线” 变化——从中年(12 月龄)达到峰值,到老年期(21 月龄)开始下降。
GLO1 的保护作用与衰老后的衰退紧密关联。当 GLO1 处于高表达状态时,它能通过清除活性羰基化合物产生的有害糖化产物,抵消钙泄漏的部分毒性,为大脑提供关键保护。但在老年突变小鼠体内,随着 GLO1 活性下降,其在 T 型迷宫工作记忆测试中表现出明显缺陷,这意味着大脑的 “解毒盾牌” 随衰老削弱后,钙泄漏对认知功能的损伤便会集中显现。对突变小鼠突触体的蛋白质组学分析进一步证实,GLO1 的上调是大脑对慢性钙泄漏的代偿性保护反应,其表达变化直接影响着神经细胞的抗损伤能力。
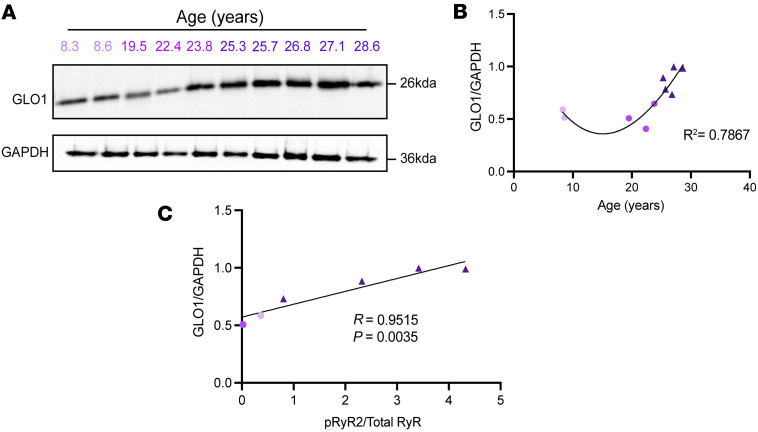
在恒河猴大脑中,GLO1的表达随年龄增长而增加,并与p-S2808-RyR2的水平呈正相关
这项研究的意义远超基础机制探索,它的核心价值体现在四个方面:一是首次阐明了大脑的内在 “韧性” 机制,证实阿尔茨海默病早期大脑会通过上调 GLO1 主动应对钙稳态失调,打破了 “大脑面对神经损伤只能被动承受” 的认知;二是解释了 “年龄是阿尔茨海默病最大风险因素” 的核心悖论。尽管疾病早期大脑会启动保护,但 GLO1 的保护能力会随年龄增长衰退,让老年大脑失去防御屏障;三是提供了全新早期干预靶点,正如研究团队的 Amy Arnsten 教授所言,若能维持 GLO1 的保护机制,就能以大脑自身的方式抵御损伤,通过药物或其他手段增强 GLO1 活性,有望成为预防阿尔茨海默病的新策略;四是搭建了基础研究与临床应用的桥梁,将早期损伤机制转化为可干预的明确靶点,为 “治未病” 的疗法开发扫清了关键障碍。
未来的阿尔茨海默病防治思路或将迎来重要转变:与其在神经元大量死亡后艰难修复,不如在疾病启动早期、甚至中老年认知功能开始下滑前,加固大脑自身的 “韧性盾牌”。目前已有大量研究聚焦于阿尔茨海默病的治疗,而随着上游生物学机制逐渐清晰,预防性疗法的开发已具备明确方向。
也许在不久的将来,通过增强大脑与生俱来的 GLO1 解毒系统,我们能帮助无数人守住记忆防线,让衰老的大脑依旧保持坚韧,这既是科学的突破,更是对健康老龄化的有力承诺。(生物谷Bioon.com)
参考文献:
Elizabeth Woo,Dibyadeep Datta,Shveta Bathla, et al. Ryanodine receptor 2-mediated calcium leak is associated with increased glyoxalase I in the aging brain, JCI Insight. 2025 Oct 16;10(22):e184041. doi:10.1172/jci.insight.184041. eCollection 2025 Nov 24.
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->





